
Брак и не только. Как работать с недоброкачественной продукцией?
Обзор вебинара Ларисы Гарбузовой о работе с недоброкачественной продукцией: последовательность действий, обеспечение документацией, варианты размещения, схемы и типы списания товаров аптечного ассортимента в МДЛП
Вопрос о качестве лекарственных препаратов критически важен: фармацевтам и провизорам нужно знать, как действовать при выявлении рисков — например, при обнаружении бракованных или просроченных упаковок. Этому вопросу был посвящён вебинар «Недоброкачественная продукция в аптеке: что делать?», который 3 апреля на платформе КС провела председатель правления Фармассоциации Санкт-Петербурга, доцент кафедры внутренних болезней, нефрологии, общей и клинической фармакологии с курсом фармации СЗГМУ им. И. И. Мечникова Лариса Гарбузова. Детальный разбор онлайн-лекции для тех, кто не смог подключиться к трансляции, в нашем сегодняшнем обзоре.
Отделить зёрна от плевел
Проблемы с качеством лекарств, пусть и очень редко, но всё же встречаются. Когда аптека сталкивается с такими «сюрпризами» — важно чётко понимать, как действовать. Главная задача работы с недоброкачественной продукцией отмечена в нормативных актах:
- согласно действующим до первого сентября текущего года Правилам надлежащей практики хранения и перевозки лекарственных препаратов (утв. Приказом Минздрава России от 31.08.2016 № 646н) процесс фармдеятельности нужно выстроить так, чтобы минимизировать риск проникновения фальсифицированных, недоброкачественных и контрафактных препаратов в гражданский оборот;
- в Правилах надлежащей аптечной практики (утв. Приказом Минздрава России от 31.08.2016 № 647н и также действующих до первого сентября нынешнего года) речь идёт о минимизации названных рисков для лекарств, медизделий и БАД. Это одна из главных составляющих системы качества в аптеке. Указание на данную цель сохранилось и в новом проекте НАП (хотя в проекте новых правил хранения лекарственных препаратов оно отсутствует).
И действительно, система качества в аптечной организации невозможна без грамотно выстроенного и понятного каждому сотруднику порядка работы с недоброкачественными, фальсифицированными и контрафактными препаратами (а также остальными товарами аптечного ассортимента). Данный вопрос должен быть детально описан в одном из ключевых локальных нормативных актов аптеки — руководстве по качеству.
Определения фальсифицированных, недоброкачественных и контрафактных лекарственных средств приведены в статье 4 ФЗ «Об обращении лекарственных средств», а процедура их уничтожения регламентирована Постановлением Правительства РФ от 15.09.2020 № 1447.
От приёмки до списания: важен каждый этап
Чтобы снизить риск попадания «некондиционных» лекарств в руки покупателя-пациента, аптеке нужно правильно выполнять следующие задачи:
- приёмочный контроль;
- соблюдение условий транспортировки и хранения (да, аптека транспортировкой не занимается, но она должна проверить, насколько верно выполнил эту функцию поставщик);
- выявление фальсифицированных, недоброкачественных, контрафактных препаратов и товаров аптечного ассортимента;
- выявление просроченных препаратов и товаров аптечного ассортимента (контроль сроков годности в аптеке должен быть обязательно);
- изолирование фальсифицированных, недоброкачественных, контрафактных и просроченных препаратов и товаров аптечного ассортимента (т. е. их хранение отдельно от продукции надлежащего качества);
- передачу на уничтожение тех препаратов и товаров аптечного ассортимента, которые не должны находиться в обороте;
- регулярный контроль всех перечисленных процессов.
Изоляция — дело тонкое
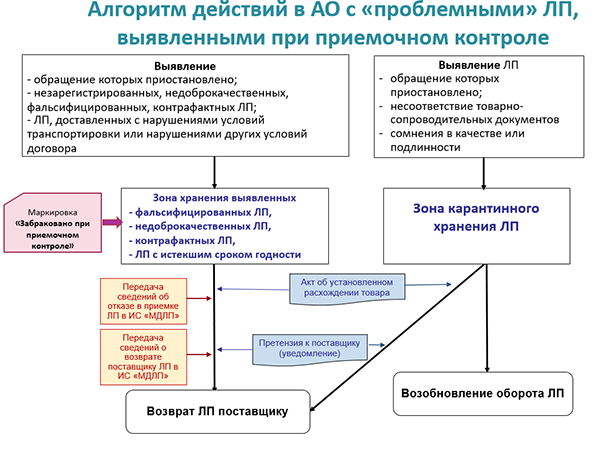
Чтобы «проблемные» препараты и ТАА можно было «отграничить», в аптеке должны быть организованы карантинные зоны. К этому процессу есть определённые требования.
Во-первых, вся продукция с проблемами качества обязательно идентифицируется и размещается изолированно от остальных, доброкачественных товаров. Во-вторых, сама карантинная зона должна быть чётко отделена от других пространств — и тоже идентифицирована, чтобы ни у кого из сотрудников не возникало вопросов о её задачах и назначении. Эти нормы установлены пунктами 30 и 55 Правил надлежащей практики хранения и перевозки, а также пунктом 66 НАП. Оба документа предусматривают наличие СОП, регламентирующих работу с карантинными зонами.
Согласно п. 15 НАП, п. 24 Правил надлежащей практики хранения и перевозки и ОФС. 1.1.0010 «Хранение лекарственных средств» в аптеке должны быть выделены:
- зоны карантинного хранения лекарственных препаратов;
- зона хранения выявленных фальсифицированных, недоброкачественных, контрафактных и просроченных препаратов;
- зона карантинного хранения других товаров аптечного ассортимента.
Лекарства перемещаются в карантинные зоны, если:
- их обращение приостановлено в соответствии с письмами Росздравнадзора или решением Минздрава (однако серии могут вернуться в оборот, как произошло в апреле с «Атревозолом»);
- отсутствуют необходимые сведения в товарно-сопроводительных документах поставщика — либо данные этой документации расходятся с фактической информацией. После уточнения вопроса о нестыковках препараты тоже могут возвратиться в обращение;
- имеются сомнения в качестве или подлинности (которые предстоит проверить).
Принятые в аптеке меры изоляции сомнительной фармпродукции должны гарантировать исключение её попадания к покупателям.
Когда лекарства обещают вернуться
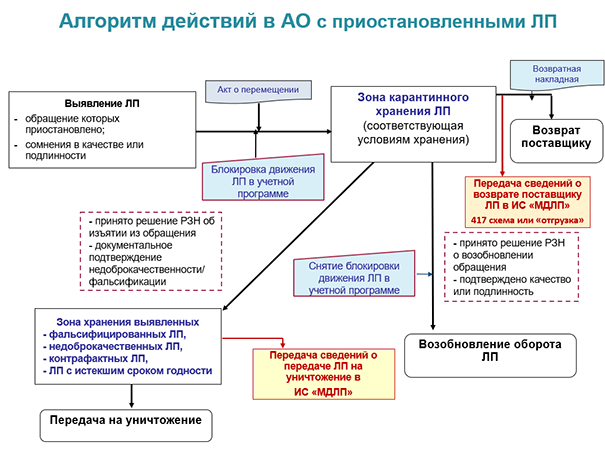
Зона карантинного хранения — это зона ожидания для продукции, у которой есть вероятность возобновления законного оборота. Список ситуаций, когда лекарственные препараты должны попадать в «карантин», достаточно обширен:
- приостановка обращения по решению Росздравнадзора;
- приостановление применения по решению Минздрава;
- приостановка обращения по решению владельца ЛП, т. е. аптеки. Например, из‑за испорченного кода маркировки. Если таких ошибок много (допустим, во время выпуска серии произошёл сбой на линии), то производитель или импортёр может перемаркировать такие препараты. Сомнения в подлинности или качестве лекарств, а также расхождения фактических данных с информацией в товарно-сопроводительных документах тоже требуют «карантина».
В «карантинной» зоне должны соблюдаться условия хранения всех размещённых препаратов — в т. ч. термолабильных, иммунобиологических и подлежащих ПКУ. Для каждой из этих категорий должен быть отдельный «отсек». Если среди «учётных» лекарств есть НС и ПВ, им тоже понадобится своя карантинная зона — с обязательным выполнением всего списка установленных требований.
В некоторых других случаях лекарства попадают в зону изъятых из обращения препаратов (фальсифицированных, недоброкачественных, контрафактных и просроченных). Это:
- прекращение обращения / изъятие из обращения по решению Росздравнадзора;
- отзыв из обращения по решению производителя/держателя регудостоверения (уполномоченного представителя);
- отмена госрегистрации, но не по заявлению держателя регудостоверения, а по другим причинам;
- исключение из госреестра той фармсубстанции, которая применялась при аптечном изготовлении.
В зоне изъятых из обращения лекарств нет смысла соблюдать физико-химические условия хранения — температуру и влажность. Но вот действующие параметры хранения препаратов ПКУ применяются обязательно.
Хранить в надёжных руках
Порядок организации работы с некачественными и другими потенциально небезопасными товарами аптечного ассортимента (ТАА) аптека или аптечная сеть формулирует самостоятельно: руководитель организации издаёт внутренний приказ, где максимально подробно описывает все важнейшие детали.
Первый из обязательных шагов — назначение ответственного лица за работу с фальсифицированными, недоброкачественными, контрафактными ТАА, ТАА с истёкшим сроком годности и ТАА, обращение которых приостановлено (этого требует пункт 66 Правил надлежащей аптечной практики). Таких ответственных может быть несколько.
Второй важный момент — перечислить обязанности ответственного лица. Среди них должны быть:
- своевременное изъятие из обращения недоброкачественной продукции и перемещение её в соответствующие «карантинные» зоны с оформлением необходимых документов (например, актов о перемещении);
- обеспечение сохранности продукции в «карантинных» зонах, исключение её попадания в обращение;
- подготовка и передача недоброкачественной продукции на уничтожение или для возврата поставщику;
- передача продукции в основные места хранения или отпуска при возобновлении обращения.
Третья задача — выбрать место, способ выделения и маркировку карантинных зон (это тоже отмечено в п. 66 НАП). В данной части приказа никакие общие слова недопустимы! Нужно чётко описывать помещения, мебель и другие предметы в конкретной аптеке. Например, так:
- «выделить и обозначить зону карантинного хранения лекарственных препаратов, не требующих особых условий хранения, в запирающемся шкафу № 1 в помещении хранения»;
- «выделить и обозначить зону карантинного хранения термолабильных лекарственных препаратов в холодильнике № 1 (температурный режим от +2 °C до +8 °C) — запирающийся контейнер с крышкой».
Шкафы, конечно, могут быть и открытыми, но, как показывает практика, целесообразнее выбор запирающейся мебели. Ключи от запирающихся шкафов и контейнеров должны храниться у ответственного лица.
Четвёртый шаг — утвердить СОП «Порядок работы с недоброкачественной продукцией в аптечной организации», где могут быть разделы о подготовительных операциях, порядке действий с недоброкачественными лекарственными препаратами, недоброкачественными медизделиями и т. д. Следует разработать и другие необходимые формы документов (в первую очередь, акты о перемещении и списании с передачей на уничтожение).
Пятое важное действие, обязательное к включению в текст внутреннего приказа, — информирование сотрудников о порядке работы с недоброкачественной продукцией. Здесь нужно перечислить все должности, требующие ознакомления специалистов с данным порядком.
Шестая задача — организовать внутреннее обучение сотрудников аптеки (в этом пункте приказа тоже понадобится перечисление должностей) вопросам порядка работы с недоброкачественной продукцией в аптечной организации и включить его в соответствующий план-график.
Акт о перемещении и другая документация
При перемещении лекарств в зону карантинного хранения (либо зону хранения фальсифицированных, недоброкачественных, контрафактных и просроченных препаратов) аптека вправе составить акт о данном действии. Форма акта о перемещении действующим законодательством не установлена, поэтому аптечная организация разрабатывает и утверждает её самостоятельно. В некоторых учётных системах есть шаблоны подобных документов.
Акт о перемещении лекарственных препаратов составляется и подписывается комиссией. В нём нужно указать наименования лекарств, их серии и сроки годности, производителей, поставщиков, даты поставки, номера накладных, количество упаковок, оптовые и розничные цены. Для удобства прочтения информация может быть представлена в табличной форме.
Нужны и другие документы, подтверждающие правильность работы аптеки с недоброкачественной продукцией на различных этапах товародвижения.
Если несоответствия были выявлены в процессе приёмочного контроля, составляется акт об установленном расхождении по количеству и качеству при приёмке товарно-материальных ценностей и претензия поставщику (согласно ст. 483 ГК РФ «Извещение продавца о ненадлежащем исполнении договора купли-продажи»).
При возврате продукции поставщику у аптеки должна остаться копия возвратной накладной и копия договора с поставщиком, подтверждающего возможность и условия возврата.
Для списанных и переданных на уничтожение препаратов и ТАА понадобится целый пакет документов:
- приказ о списании ТАА, подлежащих уничтожению (с копией); акт о списании (также с копией);
- выписка из реестра лицензий, подтверждающая право организации, проводившей утилизацию, на обезвреживание отходов I–IV класса опасности. К таким отходам могут относиться не только лекарства, но и некоторые другие товары аптечного ассортимента;
- копия договора с организацией, проводившей утилизацию отходов;
- и акт об уничтожении ТАА.
Контролирующий орган нужно проинформировать
Статья 37 ФЗ «О техническом регулировании» содержит ещё одно важное для аптеки положение: если организации, которая задействована в процессе розничной продажи продукции, стало известно, что выпущенный в обращение товар не отвечает требованиям технических регламентов, нужно сообщить об этом в профильный контрольно-надзорный орган в ближайшие десять дней с момента получения информации.
Конечно, лекарственные препараты и медизделия выведены из сферы действия ФЗ «О техническом регулировании», однако сообщать о выявленных проблемах с их качеством в территориальное управление Росздравнадзора всё равно необходимо. Если же проблемный товар относится к БАД и другим видам нелекарственного аптечного ассортимента, следует передать информацию уже в региональный орган Роспотребнадзора.
На официальную электронную почту профильных контролирующих органов (но, ещё раз подчеркнём, не центральных аппаратов, а территориальных управлений) нужно отправить письма со следующими данными:
- какие наименования и серии препаратов или ТАА оказались «проблемными»;
- что послужило причиной их изолирования от доброкачественной продукции;
- какие действия были выполнены с сомнительным товаром.
Ответственность за молчание в таких ситуациях предусмотрена частью первой статьи 14.46.2 КоАП: размер штрафа для юрлиц составляет от 10 до 30 тысяч рублей.
Проверка информации должна быть комплексной
Своевременно выявить небезопасную продукцию аптеке помогут:
- получение данных из системы МДЛП. Этот способ должен быть первым, но не единственным. Показателен недавний пример: когда лицензионный контроль выявил нарушения правил GMP у компании «Джодас Экспоим», и Минздрав временно остановил обращение ряда выпускаемых на этом производстве препаратов, «Честный знак» почему‑то заблокировал передвижение большего числа наименований, чем было приведено в письме МЗ РФ. От технических сбоев, действительно, не застрахована ни одна система. Поэтому фармацевтическому работнику стоит обратиться к сайтам органов власти, принявших решения насчёт оборота тех или иных серий;
- просмотр информационных баз и сервисов Росздравнадзора;
- просмотр баз данных Минздрава;
- контроль сроков годности;
- никто не отменял и визуальный контроль качества, причём не только на этапе приёмки. Нужно проверить наличие кода маркировки, его соответствие описанию, комплектность, целостность упаковки, наличие на упаковке обязательной информации.
Для проверки госрегистрации лекарственных препаратов следует обратиться к данным ГРЛС либо Единого реестра зарегистрированных лекарственных средств ЕАЭС.
Сведения о приостановлении применения по решению Минздрава или отмене действия регудостоверения можно найти тоже на сайте ГРЛС, в разделе «Безопасность лекарственных препаратов»: https://grls.rosminzdrav.ru/default.aspx.
На сайте Росздравнадзора есть и другие полезные данные:
- о лекарствах, вводимых в гражданский оборот, — https://www.roszdravnadzor.ru/services/turnover;
- поиск изъятых из обращения лекарств — www.roszdravnadzor.ru/services/lssearch;
- поиск писем по контролю качества лекарств — www.roszdravnadzor.ru/services/qclssearch.
Напомним, что препарат, регистрация которого отменена по решению держателя регудостоверения, может оставаться в обращении до завершения срока годности. Изымать его из аптеки не нужно! А вот при отмене госрегистрации субстанций таких исключений нет: если компонент вычеркнут из реестра, аптечное изготовление препаратов с этим веществом строго воспрещается.
Возврат по адресу отправителя
Вернуть лекарственный препарат поставщику аптека может, если:
- он был отозван из обращения по решению производителя /держателя регудостоверения / уполномоченного представителя / дистрибьютора;
- произошёл отзыв из обращения / прекращение обращения / изъятие из обращения по решению Росздравнадзора;
- имеются другие основания согласно условиям договора с поставщиком (их при подписании соглашения нужно прописать максимально детально).
В процессе возврата нужно внести в систему МДЛП необходимые данные:
- схема 415/416 с типом 2 «возврат» — если нет блокировки движения препарата в системе МДЛП (т. е. он отозван «по собственному желанию»);
- схема 417 — если есть официальное решение Росздравнадзора о приостановлении и осуществлена блокировка движения препарата в системе МДЛП.
Напомним, что возврат через маркировку возможен только для целых упаковок: разукомплектованные пачки лекарственных препаратов придётся списать.
Через несколько дней стоит уточнить статус возвращённых поставщику лекарств в личном кабинете в системе МДЛП — и убедиться, что они уже не значатся на балансе аптеки.
Попытка номер два
Если, например, больничная аптека уже отдала лекарства в отделение стационара, вернуть их поставщику разрешается. Но при одном условии: следует выполнить повторный ввод в оборот по схеме 391. Данную функцию вправе выполнять только тот, кто выводил лекарственные препараты из обращения.
Схема 391 применяется не позднее, чем через 60 дней после «первичного» вывода из оборота. Использовать её можно, если лекарство было выведено из обращения:
- при продаже, отпуске по льготному рецепту;
- при выдаче для оказания медицинской помощи;
- по причине списания;
- при отборе образцов в рамках выборочного контроля Росздравнадзора. При этом нельзя повторно ввести в оборот препараты, выведенные по типу 19 — отбор контрольных образцов в рамках процесса контроля качества или 20 — отбор архивных образцов;
- при реэкспорте;
- при отгрузке незарегистрированному участнику (возврат от незарегистрированного участника);
- при перемещении в карантинную зону.
Как правильно списать лекарства
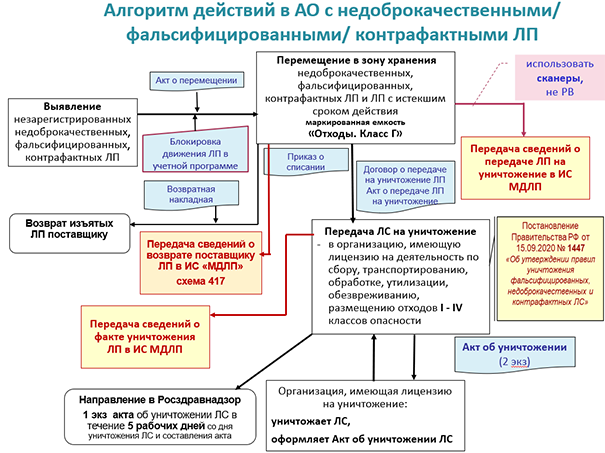
Передаче на уничтожение подлежат:
- просроченные препараты;
- препараты, изъятые из обращения по решению Росздравнадзора или суда;
- наименования с отменённой госрегистрацией (но не по заявлению держателя регудостоверения).
Возможны и другие основания.
Подлежащие передаче на уничтожение препараты хранятся в зоне изъятых из обращения лекарственных средств, в ёмкости, маркированной надписью «Отходы класса Г» (согласно Приказам Минздрава №№ 646н и 647н и Постановлению Главного госсанврача РФ от 28.01.2021 г. № 3 «Об утверждении СанПиН 2.1.3684–21…», раздел X «Требования к обращению с отходами»). По мере накопления они передаются в организацию, имеющую лицензию на деятельность по работе с отходами I–IV классов опасности.
В систему МДЛП при этом вносятся сведения о выводе препарата из оборота по схеме 541 «Передача на уничтожение». В документе 541 нужно отметить реквизиты акта приема-передачи (act_number — номер акта, act_date — дата акта). В поле указывается код ФИАС юридического адреса организации, проводящей процедуру уничтожения. Проинформировать систему маркировки нужно за пять рабочих дней со дня передачи лекарств на уничтожение.
При утилизации препаратов организация, которая имеет право выполнить данную процедуру, составляет акт об уничтожении и передаёт его в аптеку.
Этот документ должен содержать:
- сведения о дате и месте уничтожения лекарственных средств;
- ФИО лиц, принимавших участие в процедуре, их место работы и должность;
- обоснование необходимости утилизации;
- сведения об уничтоженной продукции (наименование, лекформа, дозировка, единицы измерения, серия, производитель) и её количестве, таре или упаковке;
- информацию о владельце препаратов;
- способ уничтожения лекарственных средств.
В течение 5 рабочих дней после получения акта нужно не только передать его копию в Росздравнадзор, но и внести в систему МДЛП соответствующие сведения (схема 542). Ещё через несколько дней нужно проверить статус утилизированных лекарств в личном кабинете и убедиться, что они не числятся на балансе аптеки.
Когда флакон с лекарством разбился и передать его на уничтожение невозможно, в системе МДЛП применяется схема 552, тип 13 — списание без передачи на уничтожение. В некоторых случаях подойдёт тип 16 — списание разукомплектованной потребительской упаковки. При перемещении в карантин возможно применить тип 27 — перемещение в карантинную зону. Этот способ подойдёт, если, например, истёк срок годности у двух-трёх упаковок (т. е. количество слишком мало для передачи на утилизацию, а зависшие остатки в системе МДЛП допускать нельзя).
Если решение принял контролирующий орган
Отправить лекарства на утилизацию может суд, Росздравнадзор или сама аптека (когда, например, истёк срок годности). Если решение принято Росздравнадзором, то в течение 30 дней со дня получения этого документа нужно изъять указанные в нём препараты из обращения, изолировать и разместить их в специально выделенном помещении (зоне), либо сообщить о несогласии с указанным решением. В течение 6 месяцев со дня получения решения об уничтожении должна быть выполнена сама процедура.
Решение об уничтожении лекарственных средств, принятое Росздравнадзором и переданное владельцу лекарств (т. е. аптеке), должно содержать:
- сведения об утилизируемой продукции;
- основания и сроки изъятия и уничтожения препаратов;
- сведения о владельце и производителе лекарственных средств.
Если утилизация «некондиционных» лекарств проводится по решению аптеки, сроки процедуры могут быть любыми.
10 мая 2025
Текст: Екатерина Алтайская
Фото: www.istockphoto.com/MJ_Prototype
Выпуск: №257, май 20251256 просмотров
1256 просмотров
Поделиться ссылкой с друзьями ВКонтакте Одноклассники
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.

 Катрен Стиль
Катрен Стиль


зарегистрированным пользователям